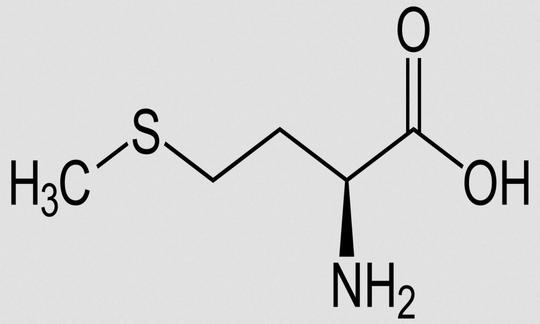
Methionin (Met, M)
Langfristig hohe Methioninzufuhr kann im Körper die Calciumausscheidung erhöhen und das Risiko für Osteoporose steigern.
Methionin fördert die Proteinbiosynthese, doch lernen Sie im Text, wozu sie zudem dient und wie Sie ein Optimum davon erhalten.
Die Versorgung mit Makro- und Mikronährstoffen ist bei einer ausgewogenen, pflanzenbasierten Ernährung mit wenig bis keinen industriell verarbeiteten Lebensmitteln in der Regel gegeben, mit Ausnahme von Vitamin B12. Doch vor allem sekundäre Pflanzenstoffe sind relevant für die Aufrechterhaltung der Gesundheit und Heilung von Krankheiten, obwohl sie nicht als essenzielle Nährstoffe gelten - ausser Vitamine.
---
Definition
Methionin (Met, M) ist eine von acht (bei Kindern zehn, einschliesslich Histidin und Arginin) Aminosäuren, die für den menschlichen Organismus als essenziell (nicht entbehrlich) gelten. Der Mensch verwendet 21 proteinogene Aminosäuren. Das sind die Bestandteile der Proteine. Bis auf zwei (Lysin und Threonin) kann der Körper die Proteine seinem Bedarf anpassen, auch wenn man klassisch acht als essenziell bezeichnet. Neben Cystein ist Methionin die einzige schwefelhaltige proteinogene Aminosäure.5
Vorkommen
Besonders reich an Methionin sind Nüsse und Samen.
| Lebensmittel | Protein g/100 g (USDA) | Methionin mg/100 g | %-Anteil Methionin am Protein |
| 14 g | 1100 mg | 7,8 % | |
| Hanfsamen ungeschält | 32 g | 930 mg | 2,9 % |
| 18 g | 590 mg | 3,3 % | |
| 17 g | 590 mg | 3,5 % | |
| 24 g | 350 mg | 1,5 % | |
| 14 g | 310 mg | 2,2 % | |
| 15 g | 260 mg | 1,7 % | |
| 15 g | 236 mg | 1,6 % |
Aber auch Kürbiskerne (600 mg/100 g) oder Hülsenfrüchte und gewisse Getreidesorten liefern gute Mengen der Aminosäure Methionin.2 Im Gemüse hingegen sind die Mengen an schwefelhaltigen Aminosäuren gering, beispielsweise Spinat (55) und Brokkoli (44).1
Damit enthalten Paranüsse (oder Spirulina mit 1100 mg/100 g) nahezu das Doppelte an Methionin als Fleisch (Rindfleisch roh 554) und Fisch und etwa dreimal so viel wie Ei (380) oder zwölfmal so viel wie Kuhmilch (82 mg).1
Als Veganer müsste man sich schon sehr einseitig ernähren, um einen andauernden Eiweissmangel zu erleiden, der zu Marasmus oder Kwashiorkor (Hungerbauch) führt. Andererseits zeigen die Beispiele oben, dass man sowohl Gemüse, Früchte, als auch Nüsse und Samen in der Ernährung berücksichtigen sollte.
Lager- und Zubereitungsverluste
Das Erhitzen der Speisen denaturiert Proteine und verändert damit deren Eigenschaften. Ein Beispiel ist das Spiegelei, das durch die Hitze in der Pfanne denaturiert. Beim Erhitzen das Ei verfestigen sich das flüssige Eigelb und das Eiklar, die Hauptproteinquelle. Die Proteine im Ei verdicken sich, ein Prozess, der als "Gerinnung" oder "Ausflocken" bekannt ist. Das Eiklar gerinnt bei 60 °C, das Eigelb bei 65 °C, und die vollständige Gerinnung erfolgt bei 70 °C.7
Die Proteinoxidation einer Aminosäure durch Reaktive Sauerstoffspezies kann dessen Funktion erheblich beeinflussen. Zu langes Kochen oder Einweichen von methioninhaltigen Nahrungsmitteln, kann zum Auswaschen von wesentlichen Mengen der Aminosäure führen.
Ernährung - Gesundheit
Methionin spielt eine bekannte Rolle als Initiator der Proteinsynthese in Prokaryoten und Eukaryoten, stabilisiert die Proteinstruktur, wirkt als endogenes Antioxidans an der Oberfläche von Proteinen und ist eine der vier häufigsten schwefelhaltigen Aminosäuren (Methionin, Cystein, Homocystein und Taurin).9,12
Es gehört zu den essenziellen Aminosäuren. Essenzielle Aminosäuren sind diejenigen, die unser Körper entweder nicht oder nicht in ausreichender Menge synthetisieren kann, um das Wachstum und die Stickstoffbilanz aufrechtzuerhalten. Der Mensch kann Methionin aus der Nahrung oder aus gastrointestinalen Mikroben gewinnen.8,12
Inzwischen weiss man, dass der Körper nur Lysin und Threonin irreversibel transaminiert und nur die zwei wirklich essenziell sind.5 Veganer erhalten Methionin eher etwas unterdurchschnittlich, doch kann der Körper es aus Cystin herstellen, das er in ausreichender Menge erhält. Das weiss man erst seit einigen Jahren.
Spezielle Essgewohnheiten, wie bei Frutariern (Fructarier, Frutaner, Fruganer) oder der 80/10/10 (High-Carb-Diät) und noch extremeren Diäten, können im Laufe der Zeit zu Mangelerscheinungen führen. Dies geschieht oft über lange Zeit ohne direkt erkennbare Symptome.
| Nicht nur Veganer oder Vegetarier sollten das Lesen: Veganer essen oft ungesund. Vermeidbare Ernährungsfehler. |
Tagesbedarf auf lange Sicht
Zumindest für Erwachsene gilt es als gesichert, dass der Körper den gesamten Bedarf an der Aminosäure Cystein aus Methionin synthetisieren kann, sofern die Nahrung genug Methionin.5
Gesunde Erwachsene haben einen mittleren Methionin-Bedarf von 13 mg/kg Körpergewicht pro Tag. Adäquate Aufnahme von Cystein minimiert den Methioninbedarf. Die WHO gibt eine Tagesmenge von 13 mg/kg Körpergewicht pro Tag an schwefelhaltigen Aminosäuren (Cystein und Methionin) an.6,10
Allerdings beträgt der Mindestbedarf an Methionin inkl. 30 % Zuschlag für individuelle Schwankungen nach wissenschaftliche Tabellen Geigy, Bd.2, S. 232 nur 10 mg/kg Körpergewicht. Dies inkl. dem Cystin (nicht Cystein). Das wären für einen 75 kg schweren Menschen 750 mg/Tag. Neuere wissenschaftliche Quellen gehen sogar von weniger aus.
Mangelerscheinungen bzw. Mangelsymptome
Ein Mangel ist bei ungenügender Zufuhr über die Nahrung mit langer Dauer möglich. Eine ausgewogene natürliche vegane Ernährung deckt Methionin gut ab und bei mehr Muskelarbeit isst man auch mehr. Säuglinge sind besonders gefährdet, wenn sie von Muttermilch zu früh entwöhnt sind und falsche Nahrung erhalten.
Ein langanhaltender Mangel kann zu Stoffwechselstörungen, verstärkter Müdigkeit und depressiven Verstimmungen führen. Die bei sehr langandauerndem Eiweiss- und generellem Energiemangel entstehenden Krankheiten Kwashiorkor und Marasmus findet man in der westlichen Welt kaum mehr. Leichtere Mangelerscheinungen können bei Kindern zu vermindertem Wachstum und bei Erwachsenen zum Verlust fettfreier Körpermasse führen.8
Überversorgung
Methionin gilt als die am stärksten toxische Aminosäure. Bei zu hoher Zufuhr bildet sich durch den Abbau von Methionin als Zwischenprodukt Homocystein, ein gefässschädigender Stoff. Ein anhaltend hoher Verzehr methioninreicher Lebensmittel erhöht die Calciumausscheidung und begünstigt damit die Entwicklung einer Osteoporose. Die gleichzeitige ausreichende Aufnahme an Folsäure, Vitamin B6 (Pyridoxin), Vitamin B12 (Cobalamine) und Vitamin C tragen dazu bei, Homocystein rascher abzubauen und in Methionin zurückzuwandeln.11
Bei Säuglingen führt eine Methioninzufuhr im Bereich des zwei- bis fünffachen des Normalwerts zu Wachstumsstörungen.11
Bei der Verstoffwechselung von überschüssigem Methionin oxidiert der enthaltene Schwefel zu Schwefelsäure und scheiden sie über die Nieren aus, wodurch der Harn angesäuert entsteht.
Funktionen im Körper
Methionin weist verschiedene Funktionen im Körper auf:2,3,4,5,14
- Bei der Proteinbiosynthese dient Methionin im Rahmen der Translation als Starter-Aminosäure.
- Methionin trägt im Körper dazu bei, übermässige Fetteinlagerungen in der Leber zu verhindern.
- Bei der Verstoffwechselung von überschüssigem Methionin oxidiert der in der Substanz enthaltene Schwefel zu Schwefelsäure. Die Nieren scheiden diese aus, was zur Ansäuerung des Harns führt und somit zur Hemmung des Bakterienwachstums bei Harnwegsinfektionen.
- Methionin ist im Stoffwechsel für diverse Biosynthesen zuständig. Dies für Cholin, Kreatin, Adrenalin, Carnitin, Nukleinsäuren, Histidin, Taurin und Glutathion (Transmethylierung). Die stoffwechselaktive Form von Methionin ist S-Adenosylmethionin.
- Methionin wirkt antioxidativ und kann Schwermetalle ausleiten.
- Zudem kann es den Histaminspiegel senken und spielt auf diese Weise bei allergischen Reaktionen eine Rolle.
- Methionin ist erforderlich, um Selen aus der Nahrung aufzunehmen und im Körper zu transportieren.
- Methionin kann depressive Stimmungen positiv beeinflussen.
Aufnahme und Stoffwechsel
Die Verdauung der mit der Nahrung aufgenommenen Proteine beginnt im Magen durch Pepsine. Sie spalten die Proteine in Peptide. Die weitere Spaltung in die einzelnen Aminosäuren geschieht im Dünndarm durch Peptidasen. Die zelluläre Aufnahme erfolgt durch verschiedene Carrierproteine, die spezifisch für bestimmte AS-Gruppen sind.
Der erste Schritt im Metabolismus von Methionin ist die Umwandlung in Homocystein über das Zwischenprodukt S-Adenosylmethionin (SAM). SAM fungiert als wichtiger Methyl-Donor und ist an verschiedenen Methylierungsreaktionen beteiligt.
Homocystein remethyliert zu Methionin und verbleibt im Methylierungszyklus, oder baut sich über den Transsulfurierungsweg in Kombination mit Serin zu Cystathionin ab. Das sich dann wiederum in α-Ketobutyrat und Cystein spaltet.5,11,12
Speicherung - Verbrauch - Verluste
Proteine unterliegen einem ständigen Auf- und Abbau. 70-80 % der freien Aminosäuren befinden sich in der Skelettmuskulatur, ein geringerer Anteil im Blutplasma. Das zentrale Organ für die AS-Regulation ist die Leber. Bei Überschuss kommt es zum Abbau von Methionin in die nicht essenzielle Aminosäure Cystein oder weiter zu Sulfat und Taurin.5
Strukturen
Methionin hat ein Schwefelatom organisch in der Seitenkette gebunden. Die Bindung CH3-S-CH2-R– nennt man Thioether, wobei das R für den organischen Rest des Methioninmoleküls steht.
Andere Bezeichnungen für Methionin: 2-Amino-4-methylmercaptobuttersäure; α-Amino-γ-methylmercaptobuttersäure; Acimetion. IUPAC Name: 2-Amino-4-(methylsulfanyl)butansäure (ohne Stereochemie). Summenformel: C5H11NO2S. Abkürzungen: Met, M (Einbuchstabencode).13
Literaturverzeichnis - 14 Quellen (Link zur Evidenz)
| 1. | US-Amerikanische Nährwertdatenbank USDA. |
| 2. | Elmadfa I, Leitzmann C. Ernährung des Menschen. 5. Auflage. Verlag Eugen Ulmer: Stuttgart. 2015. |
| 3. | De Groot H, Farhadi J. Ernährungswissenschaft. 6. Auflage. Verlag Europa-Lehrmittel: Haan-Gruiten. 2015. |
| 4. | Kasper H, Burghardt W. Ernährungsmedizin und Diätetik. 11. Auflage. Elsevier GmbH, Urban & Fischer Verlag: München. 2009. |
| 5. | Biesalski HK, Grimm P. Taschenatlas der Ernährung. 6. Auflage. Georg Thieme Verlag: Stuttgart und New York. 2015. |
| 6. | Raguso CA, Regan MM et al. Cysteine kinetics and oxidation at different intakes of methionine and cystine in young adults. Am J Clin Nutr. 2000 Feb;71(2):491-499. |
| 7. | Ifst Institute of Food Science & Technology. Protein: Coagulation. 2017. |
| 8. | Watford M, Wu G. Protein. Adv Nutr. 2011 Jan;2(1):62-63. |
| 9. | Aledo JC. Methionine in proteins: The Cinderella of the proteinogenic amino acids. Protein Sci. 2019 Oct;28(10):1785-1796. |
| 10. | WHO World Health Organization. Protein and amino acid requirements in human nutrition. Technical Report Series: 935. 2002. |
| 11. | Garlick PJ. Toxicity of methionine in humans. J Nutr. 2006 Jun;136(6 Suppl):1722S-1725S. |
| 12. | Parkhitko AA, Jouandin P et al. Methionine metabolism and methyltransferases in the regulation of aging and lifespan extension across species. Aging Cell. 2019 Dec;18(6):e13034. |
| 13. | Pubchem.ncbi.nlm.nih.gov. Methionine. |
| 14. | Karas Kuželički N. S-Adenosyl Methionine in the Therapy of Depression and Other Psychiatric Disorders. Drug Dev Res. 2016 Nov;77(7):346-356. |
Für diese weisse Bohnen mit Apfel, Birne und Bratkartoffeln weicht man davor Bohnen über Nacht in Wasser ein. Im Buch findet sich ein passender Löwenzahnsalat.
Geräucherte Cashew-Croquetas, serviert mit in Portwein glasierter Roter Bete und aromatischer Orangenemulsion, sind leckere und vegane spanische Tapas mit Panko
Dieses "Tailgate-Chili mit Borlotti-Bohnen" ist ein deftiges Gericht, das Sie nach Belieben einfach modifizieren können. Hier mit Maiskolben und Tomaten.
Getrocknete Steviablätter (bio?) enthalten Steviosid. Sie sind süsser als Rübenzucker, zahnfreundlich und praktisch kalorienfrei. Bei schonender Trocknung roh.
Die Cyanobakterien Spirulina (Pulver etc.) kann man praktisch nie roh kaufen. Wegen ihres blauen Farbstoffs zählte man sie früher zu den Blaualgen. Bio?
Paranüsse sind oft nicht roh, sondern hitzebehandelt. Die Paranuss passt gut zu Salat oder als Zutat für Gebäck. Vorsicht, hoher Selengehalt! Bio?





Kommentare