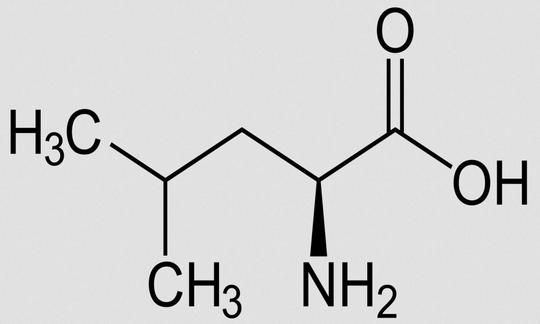
Leucin (Leu, L)
Fazit:
Eine naturnahe Ernährung inklusive Hülsenfrüchten, Nüssen und Samen deckt Leucin gut ab. Säuglinge sind dann gefährdet, wenn sie von Muttermilch zu früh entwöhnt sind.
Der Mensch verwendet 21 proteinogene Aminosäuren. Das sind die Bestandteile der Proteine bzw. Eiweisse. Bis auf zwei kann der Körper die Proteine seinem Bedarf anpassen, auch wenn man klassisch acht als essentiell bezeichnet.
Vorkommen:
Besonders reich an Leucin sind Hülsenfrüchte, Nüsse und Vollkorngetreide.
| Lebensmittel | Protein g/100g (USDA) | Leucin mg/100g (USDA) | %-Anteil Leucin am Gesamtprotein |
| 24,00 g | 1880 mg | 7,8 % | |
| 25,00 g | 1786 mg | 7,1 % | |
| getrocknete Erbsen | 24,55 g | 1760 mg | 7,2 % |
| Cashewkerne (Nuss, roh) | 18,00 g | 1472 mg | 8,2 % |
| 11,00 g | 1400 mg | 12,7 % | |
| Walnüsse (Baumnüsse) | 15,23 g | 1170 mg | 7,7 % |
| 13,70 g | 926 mg | 6,8 % |
Maisvollkornmehl (850 mg/100g) und Reis (590) zeigen auch einen grossen Bestand an Leucin. Auch Gemüse wie Spinat (200), Rosenkohl (150), Broccoli (130) sowie Früchte bringen Leucin.1
Kidney-Bohnen und Linsen beispielsweise übertreffen mit ihrem Leucin-Gehalt das Fleisch und Fisch, während Kuhmilch mit 3,7 % Fett sogar nur 321 mg/100g Leucin aufweist.
Als Veganer müsste man sich schon sehr einseitig ernähren, um einen andauernden Eiweissmangel zu erleiden, der zu Marasmus oder Kwashiorkor (Hungerbauch) führt.
| Nicht nur Veganer oder Vegetarier sollten das Lesen: Veganer essen oft ungesund. Vermeidbare Ernährungsfehler. |
Lager- und Zubereitungsverluste:
Das Erhitzen der Speisen denaturiert Proteine und verändert damit deren Eigenschaften. Dies macht sich als "Ausflocken" oder "Gerinnung" bemerkbar. Ein Beispiel ist das Spiegelei, das durch die Hitze in der Pfanne denaturiert. Die Proteinoxidation einer Aminosäure durch Reaktive Sauerstoffspezies kann dessen Funktion erheblich beeinflussen.
Ernährung / Gesundheit:
Aminosäuren sind u.a. Bestandteil von Proteinen bzw. Eiweissen. Leucin (Leu, L) ist eine der acht (mit Histidin und Arginin zehn für Kinder) für den menschlichen Organismus bisher als essentiell geltenden Aminosäuren (AS) bzw. "Eiweisse".
Inzwischen weiss man, dass der Körper nur Lysin und Threonin irreversibel transaminiert und nur die zwei wirklich essentiell sind.3-114 Veganer erhalten Threonin im Durchschnitt etwa in der zweifachen Menge und sind mit Lysin gut abgedeckt. Spezielle Essgewohnheiten, z.B. Frutarier (Fructarier, Frutaner, Fruganer) oder 80/10/10 oder noch extremer können mit der Zeit Mangel erreichen. Dies über lange Zeit ohne direkt erkennbare Symptome.
Essenziell bedeutet, dass unser Körper den Stoff nicht selbst herstellen (synthetisieren) kann, ihn aber in gewissen Mengen benötigt.
Tagesbedarf auf lange Sicht:
Der durchschnittliche Tagesbedarf für gesunde Erwachsene liegt gemäss WHO bei 39 mg Leucin pro Kilogramm Körpergewicht.4 Allerdings beträgt der Mindestbedarf inkl. 30 % Zuschlag für individuelle Schwankungen nach Wissenschaftliche Tabellen Geigy, Bd.2, S. 232 nur 16 mg/kg Körpergewicht. Das wären für einen 75 kg schweren Menschen 1,2 g/Tag. Andere wissenschaftliche Quellen gehen sogar von nur 10 mg/kg aus, also 750 mg/Tag.
Mangelsymptome:
Ein Mangel ist bei ungenügender Zufuhr über die Nahrung mit langer Dauer oder bei einer Unterversorgung mit Vitamin B6 (Pyridoxin) möglich und geht mit Abgeschlagenheit und Müdigkeit einher. Eine natürliche vegane Ernährung deckt Leucin mehr als gut ab und bei mehr Muskelarbeit isst man auch mehr. Säuglinge sind dann gefährdet, wenn sie von Muttermilch zu früh entwöhnt sind und falsche Nahrung erhalten. Die bei sehr lang andauerndem Eiweiss- und generellem Energiemangel entstehenden Krankheiten Kwashiorkor und Marasmus findet man in der westlichen Welt kaum mehr.
Überversorgung:
Ein erhöhter Leucinspiegel tritt bei einer ausgewogenen Ernährung nicht auf. Da Leucin den Muskelaufbau unterstützt und die Fettverbrennung reguliert, nehmen Sportler die Aminosäure auch als Supplement (Nahrungsergänzungsmittel) ein. Eine hohe Dosierung von Leucin durch die zusätzliche Aufnahme von Nahrungsergänzungsmitteln kann den Transport wichtiger Aminosäuren zum Gehirn behindern und zu einer gestörten Proteinbildung führen. Übelkeit, Erbrechen, Durchfall und Bauchschmerzen können auftreten.
Bei eingeschränkter Nierenfunktion sollte man sich eiweissarm ernähren, um eine vermehrte Produktion und Ansammlung von Harnstoff in der Niere durch Aminosäureabbau zu vermeiden. Aus dem Buch China Study kann man eindrücklich und mit guten Beweisen erkennen, dass wir normalerweise am Zuviel und nicht an Mangel an Proteinen leiden (siehe ausführliche Buchbesprechung): Erst seit ein paar Jahren entdeckten Wissenschaftler, dass tierisches Eiweiss, was als beste Proteinqualität (biologische Wertigkeit) galt, nicht die beste Gesundheit erzeugt, sondern das Gegenteil.
Funktionen im Körper etc.:
- Leucin ist ein wichtiger Bestandteil von Muskeleiweissen und am Aufbau neuer Gewebe beteiligt.
- Leucin stimuliert die Ausschüttung von Insulinum aus der Bauchspeicheldrüse. Damit reguliert Leucin auch den Blutzuckerspiegel und beschleunigt die Aufnahme von Aminosäuren in die Muskelzellen. Dies hat ebenfalls positive Auswirkungen auf den Muskelaufbau und senkt zusätzlich die Freisetzung des Stresshormons Cortisol.2,3-120
- Leucin fördert zudem auch die Heilung von Leber-, Gelenk- und Muskelgewebekrankheiten. Bei Kindern und Jugendlichen wirken sich die Aminosäuren positiv auf die Ausschüttung des Wachstumshormons "Somatotrop.." aus.2,3
- Bei einem erhöhten Bedarf, etwa während einer Fastenkur oder bei extremer sportlicher Anstrengung, ist freies Leucin rasch zur Energiegewinnung vorhanden. Diese Bereitstellung von Energiereserven beugt einer zu starken Abnahme von Glukose vor. Damit stehen dem Gehirn und den Muskeln weiterhin für Notfälle genügend Traubenzucker bzw. Glucose zur Verfügung.3
Aufnahme und Stoffwechsel:
Die Verdauung der mit der Nahrung aufgenommenen Proteine beginnt im Magen durch Pepsine. Sie spalten die Proteine in Peptide. Die weitere Spaltung in die einzelnen Aminosäuren geschieht im Dünndarm durch Peptidasen. Die zelluläre Aufnahme erfolgt durch verschiedene Carrierproteine, die spezifisch für bestimmte AS-Gruppen sind.
Leucin ist Ausgangsbaustein der nicht essentiellen Aminosäure Glutaminsäure, die ihrerseits ebenfalls an vielen lebenswichtigen Stoffwechselreaktionen beteiligt ist. Die Aufnahme von Leucin ist von einem ausreichenden Vitamin-B6-Spiegel abhängig.
Speicherung, Verbrauch, Verluste:
Proteine unterliegen im Körper einem ständigen Auf- und Abbau. 70-80 % der freien Aminosäuren befinden sich in der Skelettmuskulatur, ein geringerer Anteil im Blutplasma. Das zentrale Organ für die AS-Regulation ist die Leber. Dort erfolgt auch der Abbau, z.B. durch Desaminierung und Umsetzung zu Harnstoff, um zelltoxische Wirkungen zu verhindern.
Strukturen:
Leucin, abgekürzt Leu oder L, ist eine proteinogene α-Aminosäure. Gemeinsam mit Valin und Isoleucin gehört Leucin zu den verzweigtkettigen Aminosäuren, den BCAAs (Branched Chain Amino Acids). Leucin zählt zur Aspartatgruppe, weil es sich von der Asparaginsäure ableitet. Leucine, also Mehrzahl, nennt man die Zusammenfassung der vier isomeren Aminosäuren Leucin, Isoleucin, tert-Leucin und Norleucin. Siehe auch nichtproteinogene Aminosäuren.
Andere Bezeichnungen für Leucin: 2-Amino-4-methyl-pentansäure. Summenformel: C6H13NO2. Abkürzungen: Leu, L (Einbuchstabencode).
Literatur / Quellen:
In der Wissenschaft ist Wikipedia (wiki) als Quelle umstritten, auch weil bei Wikipedia Angaben zur zitierten Literatur bzw. zu Autoren häufig fehlen oder nicht verlässlich sind. Unsere Beschreibung und Piktogramme für Nährwerte enthalten kcal (1 kcal = 4.19 kJ).
- US-Amerikanische Nährwertdatenbank USDA.
- Kasper Heinrich und Burghardt Walter: Ernährungsmedizin und Diätetik; 11. Auflage (2009); Elsevier GmbH, Urban & Fischer Verlag, München.
- Biesalski Hans Konrad und Grimm Peter: Taschenatlas der Ernährung; 6. Auflage (2015); Georg Thieme Verlag, Stuttgart und New York.
- WHO: Protein and amino acid requirements in human nutrition. Technical Report Series: 935; 2002.
Für diese weisse Bohnen mit Apfel, Birne und Bratkartoffeln weicht man davor Bohnen über Nacht in Wasser ein. Im Buch findet sich ein passender Löwenzahnsalat.
Dieses "Tailgate-Chili mit Borlotti-Bohnen" ist ein deftiges Gericht, das Sie nach Belieben einfach modifizieren können. Hier mit Maiskolben und Tomaten.
Dieser Ackerbohneneintopf erhält seinen typisch orientalischen Geschmack aus der Kombination von frischem Dill, Knoblauch, gemahlenem Kurkuma und Zitronensaft.
Die Cyanobakterien Spirulina (Pulver etc.) kann man praktisch nie roh kaufen. Wegen ihres blauen Farbstoffs zählte man sie früher zu den Blaualgen. Bio?
Sojagranulat besteht aus gemahlenen, entfetteten und erhitzten Sojabohnen - ist nie roh! Wegen Eiweissgehalt und Konsistenz gilt es als (bio?) Fleischersatz.
Bierhefe hat einen würzigen, leicht käseartigen Geschmack. Man verwendet sie deshalb zum Würzen oder als Käseersatz in Speisen. Argumente für Bio.






Kommentare